Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
漆原 あゆみ; 牛込 剛史; 鹿園 直哉; 藤井 健太郎; 田内 広*; 横谷 明徳
no journal, ,
近年、電離放射線の照射によって複数の損傷が近接したクラスターDNA損傷が生じ、これが放射線による致死や突然変異誘発等の原因であると予想されている。われわれはクラスター損傷の性質を解明するために、イオンビームの種類とLETを変えて(19, 63及び121keV/ mのヘリウムイオン,87, 123, 342及び507keV/
mのヘリウムイオン,87, 123, 342及び507keV/ mの炭素イオン)、高水和状態に保ったpUC18プラスミドDNAに照射し、生じた鎖切断(ssb, dsb)生成頻度及び、照射後の修復酵素(Nth, Fpg)処理によって生じる鎖切断生成頻度の測定を行った。その結果、ヘリウムイオン照射により直接誘発されるssb量は121keV/
mの炭素イオン)、高水和状態に保ったpUC18プラスミドDNAに照射し、生じた鎖切断(ssb, dsb)生成頻度及び、照射後の修復酵素(Nth, Fpg)処理によって生じる鎖切断生成頻度の測定を行った。その結果、ヘリウムイオン照射により直接誘発されるssb量は121keV/ m照射で若干低下し、一方dsb量は63keV/
m照射で若干低下し、一方dsb量は63keV/ mにピークが現れた。また、各修復酵素処理後の鎖切断の増加量を比較したところ、LETの増加に伴い酵素修復効率の低下が見られた。LETの増加に伴いdsbが増加し、酵素による修復効率が低下していくという本研究の結果は、単独損傷が次第に密集しクラスター化して行く過程を捉えたものと考えられる。また、炭素イオンにおいても同様に研究を進めており、その結果も併せて報告したい。
mにピークが現れた。また、各修復酵素処理後の鎖切断の増加量を比較したところ、LETの増加に伴い酵素修復効率の低下が見られた。LETの増加に伴いdsbが増加し、酵素による修復効率が低下していくという本研究の結果は、単独損傷が次第に密集しクラスター化して行く過程を捉えたものと考えられる。また、炭素イオンにおいても同様に研究を進めており、その結果も併せて報告したい。
藤井 健太郎; 横谷 明徳
no journal, ,
電離放射線は、その線質あるいはエネルギーの違いによって物質との反応素過程が異なるため、線質の違いによりさまざまなDNA分子構造変化が生成される。このような線質とDNA損傷及びその後の修復についての関係を調べるため、われわれは放射線照射後にどのような分子変化が生じているかを明らかにすることを目的として研究を行っている。これまで、放射線照射中に生成する分解生成物の質量分析,照射後の最終生成物のX線吸収微細構造スペクトル分析、あるいは放射線照射中に生成するラジカル分析といった、放射光軟X線を照射しながらの分光学的「その場観察」による分析を行ってきた。これにより、放射線照射中に生じたイオン・ラジカル状態の詳細や、最終生成物のDNA分子構造変化の詳細が明らかなることが期待される。軟X線領域の放射線吸収により、DNAを構成する元素のK殻電子を電離・励起することができる。その特徴を利用して、照射する軟X線のエネルギーを選択して分析することにより、分子内の特定の元素に着目して照射による分子変化を分析することが可能となる。対象としてデオキシリボース,塩基,ヌクレオチドなどのDNA構成分子や、プラスミド(pUC18)DNA, Calf Thymus DNAを用い、それぞれに生じた分子変化の分析を行い、酵素的修復の難易性について、放射線の線質やエネルギーの違いに注目して考察を行った。
 線照射効果
線照射効果坂下 哲哉; 池田 大祐*; 浜田 信行; 鈴木 芳代*; 辻 敏夫*; 和田 成一; 舟山 知夫; 小林 泰彦
no journal, ,
50年以上にわたって、学習への電離放射線の生物学的影響が研究されてきた。現在、放射線による学習と記憶の障害は海馬における新生ニューロンの生成抑制に起因すると報告されているが、電離放射線がどのようにニューロン・ネットワーク自体に影響を及ぼすかは未だに不明な点が多い。線虫 は、ニューロン・ネットワークの機能がある程度個々のニューロンと関連付けられているモデル生物である。本研究では、新生ニューロンの生成がない成虫段階の線虫を用いて
は、ニューロン・ネットワークの機能がある程度個々のニューロンと関連付けられているモデル生物である。本研究では、新生ニューロンの生成がない成虫段階の線虫を用いて 線照射に対するニューロン・ネットワークの2つの機能、すなわち、NaClに対する化学走性とfood-NaCl連合学習の応答を調べることを目的とした。線虫をCo-60
線照射に対するニューロン・ネットワークの2つの機能、すなわち、NaClに対する化学走性とfood-NaCl連合学習の応答を調べることを目的とした。線虫をCo-60 線(0, 100, 500と1000Gy)で照射した結果、500Gy以下ではNaCl化学走性が抑制されることはなかった。また、food-NaCl連合学習により生じる化学走性の低下は、非照射群と比較して、照射により有意に亢進した(100-500Gy:化学走性に影響を与えない線量域)。これらの結果は、同じニューロン・ネットワーク内であっても、NaCl化学走性とfood-NaCl連合学習に関係する神経回路の間で
線(0, 100, 500と1000Gy)で照射した結果、500Gy以下ではNaCl化学走性が抑制されることはなかった。また、food-NaCl連合学習により生じる化学走性の低下は、非照射群と比較して、照射により有意に亢進した(100-500Gy:化学走性に影響を与えない線量域)。これらの結果は、同じニューロン・ネットワーク内であっても、NaCl化学走性とfood-NaCl連合学習に関係する神経回路の間で 線照射に対する応答が異なることを示唆している。
線照射に対する応答が異なることを示唆している。
小林 泰彦
no journal, ,
マイクロビームを用いて生きた細胞内の顕微鏡サイズの微小領域を電離放射線や紫外線で選択的に照射する細胞局部照射実験には、長い歴史がある。最初は、局部照射によって細胞構造の一部を選択的に破壊あるいは不活性化してその機能を解析するための、マイクロサージャリ実験のツールとして用いられた。その後、放射線の生物作用そのものに対する興味が深まってくると、細胞内でもっとも放射線感受性が高い部位を特定するなど、放射線の生物作用の機序を解明するための手段としても利用されるようになった。最初の粒子線マイクロビーム照射実験は1953年に2MVヴァンデグラフ加速器の陽子線を用いて行われ、さらに60年代にはサイクロトロンを用いた重陽子マイクロビームが開発された。これらの初期のマイクロビームを用いて、例えば、細胞質への局部照射が細胞の生存にほとんど影響を及ぼさないことなどが示された。しかし、当時の装置ではかなり高線量の照射実験しかできず、低線量放射線の生物影響研究のためには単一粒子照射が可能な照射装置の開発が必要であった。その後、1990年代になってから、標的細胞へのヒット数の制御が可能なマイクロビーム単一粒子照射装置が幾つかの施設で開発され、ヒット細胞とバイスタンダー細胞における照射効果を明確に区別して解析するなど、従来のランダムな照射では不可能だった実験が行われるようになった。粒子線や紫外線のマイクロビームを用いた細胞局部照射実験について、過去の数々の試みの歴史を概観し、将来を展望する。
舟山 知夫; 柿崎 竹彦; 和田 成一; 浜田 信行*; 坂下 哲哉; 宝達 勉*; 山田 直明*; 佐野 忠士*; 夏堀 雅宏*; 小林 泰彦; et al.
no journal, ,
ネコTリンパ球由来株であるFeT-J及びFL-4の電離放射線照射後に対する細胞応答について研究を行った。FeT-Jと異なり、FL-4はネコ免疫不全ウイルス持続感染株である。細胞の照射は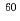 Co-
Co- 線(線量率2Gy/min)を用いた。生存率はコロニーアッセイ法で測定した。アポトーシスの評価にはTdT-mediated dUTP-biotin nick end labeling(TUNEL)法を用いた。生細胞をHoechst 33342とエチジウムブロマイドで二重染色し、生細胞のみを区別して細胞核の直径を計測した。生存率は各照射線量でFL-4がわずかにFeT-Jよりも高値を示したが、D
線(線量率2Gy/min)を用いた。生存率はコロニーアッセイ法で測定した。アポトーシスの評価にはTdT-mediated dUTP-biotin nick end labeling(TUNEL)法を用いた。生細胞をHoechst 33342とエチジウムブロマイドで二重染色し、生細胞のみを区別して細胞核の直径を計測した。生存率は各照射線量でFL-4がわずかにFeT-Jよりも高値を示したが、D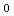 は両細胞株とも約1.9Gyと同値を示した。しかしながらTUNEL陽性率がFeT-Jは40%以上と高値を示したのに対し、FL-4は20%以下にすぎなかった。またFL-4のTUNEL陽性率がピークに達する時間はFeT-Jに比べて早く、FL-4のピークは24時間以内に達したのに対し、FeT-Jは照射後48時間以上経過してからピークに達した。さらにFL-4は
は両細胞株とも約1.9Gyと同値を示した。しかしながらTUNEL陽性率がFeT-Jは40%以上と高値を示したのに対し、FL-4は20%以下にすぎなかった。またFL-4のTUNEL陽性率がピークに達する時間はFeT-Jに比べて早く、FL-4のピークは24時間以内に達したのに対し、FeT-Jは照射後48時間以上経過してからピークに達した。さらにFL-4は 線照射により、核の巨大化あるいは多核化が確認された。細胞核の巨大化はFeT-Jに比べFL-4で顕著であった。われわれはネコTリンパ球由来である2つの細胞株間であっても細胞死への至り方が異なることを確認した。FL-4の細胞死の大半はアポトーシスによらないものであり、さらに研究を進めることでアポトーシス発現にかかわる新たな発見が期待される。
線照射により、核の巨大化あるいは多核化が確認された。細胞核の巨大化はFeT-Jに比べFL-4で顕著であった。われわれはネコTリンパ球由来である2つの細胞株間であっても細胞死への至り方が異なることを確認した。FL-4の細胞死の大半はアポトーシスによらないものであり、さらに研究を進めることでアポトーシス発現にかかわる新たな発見が期待される。
和田 成一; 小林 泰彦; 舟山 知夫; 坂下 哲哉; 横田 裕一郎; 松本 義久*; 大戸 貴代*; 細井 義夫*; 鈴木 紀夫*; 浜田 信行*; et al.
no journal, ,
高LET重イオン照射では修復困難な、又は修復不可能なDNA損傷のクラスター損傷が生じると考えられている。しかしながら、高LET重イオン照射によるDNA損傷の修復反応はいまだ詳細には解明されていない。DNA2本鎖切断修復はおもに非相同性末端結合によるので、非相同性末端結合を担うKuの高LET重イオン照射によるDNA損傷に対する反応を解析することにより、高LET重イオン照射による非相同性末端結合を調べた。照射細胞にはKu80の変異したxrs5細胞を形質転換し、GFPを融合したKu80を発現する細胞(xrs5-GFP-Ku80)とGFPのみを発現する細胞(xrs5-GFP)を用いた。照射には 線及び原研高崎のTIARAにおいてイオンビーム(LET=2.7
線及び原研高崎のTIARAにおいてイオンビーム(LET=2.7 1610keV/
1610keV/ m)を照射した。xrs5-GFP-Ku80細胞はxrs5-GFP細胞よりも放射線抵抗性であることが観察された。不活化断面積を算出したとき、xrs5-GFP-Ku80細胞とxrs5-GFP細胞の不活化断面積の差はLETが増加するにつれて小さくなった。細胞核内の
m)を照射した。xrs5-GFP-Ku80細胞はxrs5-GFP細胞よりも放射線抵抗性であることが観察された。不活化断面積を算出したとき、xrs5-GFP-Ku80細胞とxrs5-GFP細胞の不活化断面積の差はLETが増加するにつれて小さくなった。細胞核内の H2AXとKuを観察したとき、Cイオン(108keV/
H2AXとKuを観察したとき、Cイオン(108keV/ m)やNeイオン(321keV/
m)やNeイオン(321keV/ m)照射では照射10
m)照射では照射10 30分後まで
30分後まで H2AXとKuが共局在することが観察された。一方、Arイオン(1610keV/
H2AXとKuが共局在することが観察された。一方、Arイオン(1610keV/ m)照射において照射10分後では細胞内に共局在するシグナルは観察されたが、照射20分後には明確なGFPシグナルの局在化は観察されなかった。LETによって非相同性末端結合の反応は異なっていた。
m)照射において照射10分後では細胞内に共局在するシグナルは観察されたが、照射20分後には明確なGFPシグナルの局在化は観察されなかった。LETによって非相同性末端結合の反応は異なっていた。
舟山 知夫; 和田 成一; 浜田 信行*; 柿崎 竹彦; 横田 裕一郎; 坂下 哲哉; 小林 泰彦
no journal, ,
原子力機構高崎TIARAの重イオンマイクロビーム装置は、生物試料を正確かつ高速に照射し、照射効果を経時的に個々の細胞で解析することができる。これまでにCHO-K1細胞の細胞増殖がアルゴンイオンのシングルヒットで著しく阻害されるばかりか、周囲の非照射細胞の増殖も阻害することを明らかにした。このバイスタンダー効果をより効率よく正確に解析するために、装置の改良を続けている。本年は、細胞照射前の細胞位置データベースを取得するとともに照射後に効果を追跡観察するオフライン顕微鏡を増設し、細胞の照射と照射後観察の効率を向上させた。高感度冷却CCDカメラを搭載することで、GFP融合DNA修復タンパク質の照射後の動態を細胞を生かしたまま個別かつ経時的に観察できるようにした。また、植物体のような高さのある生物試料を照射するため、実体顕微鏡をベースとした別のオフライン顕微鏡も新たに導入した。この顕微鏡の導入で、従来の倒立型顕微鏡ベースでは照射位置データベースを作成できなかった高さのある試料のマイクロビーム照射も実現可能になった。
古澤 佳也*; Wang, X.*; 舟山 知夫; 小林 克己*; 今関 等*; 高城 啓一*; 中村 正信*; 菓子野 元郎*
no journal, ,
マイクロビームは放射線生物学研究を進展させるためのツールとして期待されている。生物実験用マイクロビーム施設は、国外では米コロンビア大のプロトンと 粒子の装置,英グレイ癌研究所のプロトンと
粒子の装置,英グレイ癌研究所のプロトンと 粒子による装置と蛍光X線による装置がある。またアメリカ,ドイツ,フランス,イタリア,中国で複数の施設が立ち上げを始めている。国内では原研高崎TIARA(重イオン),物構研PF(軟X線)で生物照射実験が可能であり、放射線医学総合研究所SPICE(軽イオン),長崎大(蛍光X線),京都大(重イオン),若狭湾エネルギー研究センター(軽イオン)の利用が可能になりつつある。国内での特徴は異なったビームを用いることができることである。これらのコンビネーションによって、生物物理的視点を加味した新しい観点からの研究が可能となる。
粒子による装置と蛍光X線による装置がある。またアメリカ,ドイツ,フランス,イタリア,中国で複数の施設が立ち上げを始めている。国内では原研高崎TIARA(重イオン),物構研PF(軟X線)で生物照射実験が可能であり、放射線医学総合研究所SPICE(軽イオン),長崎大(蛍光X線),京都大(重イオン),若狭湾エネルギー研究センター(軽イオン)の利用が可能になりつつある。国内での特徴は異なったビームを用いることができることである。これらのコンビネーションによって、生物物理的視点を加味した新しい観点からの研究が可能となる。
Shao, C.*; Prise, K. M.*; 古澤 佳也*; 小林 泰彦; 松本 英樹*
no journal, ,
放射線誘発バイスタンダー効果において、細胞間隙信号伝達(GJIC)が重要な役割を果たしていることがわかってきている。低線量の重イオンビームや高LET重イオンビームのヒト初代繊維芽細胞への照射により、GJICが8-Br-cAMPによって促進されるとき、非照射細胞における小核の誘発とG1期での停止が増加することを発見した。この増加はDMSOで抑制され、PMAやリンデンによって消失した。すなわちROSとGJICはコンフルエントな繊維芽細胞のバイスタンダー効果に寄与し、GJICは必須な役目をすることを示す。また、一酸化窒素やその誘導体TGF-beta1を含む幾つかの放射線誘発可溶因子は、バイスタンダーシグナル分子であり、非照射腫瘍細胞だけでなく近隣の繊維芽細胞でも染色体損傷を誘発することを明らかにした。
和田 成一; 舟山 知夫; 松本 義久*; 大戸 貴代*; 坂下 哲哉; 浜田 信行*; 横田 裕一郎; 柿崎 竹彦; 細野 義夫*; 鈴木 紀夫*; et al.
no journal, ,
高LET重イオン照射細胞におけるDNA2本鎖切断の非相同性末端結合修復を解明するため、非相同性末端結合を担うKuのDNA損傷に対する反応を解析した。照射細胞にはKu80の変異したxrs5細胞を形質転換し、GFPを融合したxrs5-GFP-Ku80とGFPのみのxrs5-GFPを用いた。そして 線及び各種イオンビーム(LET=2.7
線及び各種イオンビーム(LET=2.7 1610keV/
1610keV/ m)を照射し、細胞の生存率を調べた。いずれの照射でもxrs5-GFP-Ku80はxrs5-GFPよりも放射線抵抗性であり、不活性化断面積の差はLETが増加するにつれて小さくなった。細胞核内の
m)を照射し、細胞の生存率を調べた。いずれの照射でもxrs5-GFP-Ku80はxrs5-GFPよりも放射線抵抗性であり、不活性化断面積の差はLETが増加するにつれて小さくなった。細胞核内の H2AXとKuを観察したとき、Cイオン(108keV/
H2AXとKuを観察したとき、Cイオン(108keV/ m)照射では10
m)照射では10 30分後まで共局在が観察された。一方、Arイオン(1610keV/
30分後まで共局在が観察された。一方、Arイオン(1610keV/ m)照射では、照射10分後は共局在するシグナルは観察されたが、照射20分後には明確な局在化は観察されず、LETによってDNA修復の非相同性末端結合の反応は異なっていた。
m)照射では、照射10分後は共局在するシグナルは観察されたが、照射20分後には明確な局在化は観察されず、LETによってDNA修復の非相同性末端結合の反応は異なっていた。
斎藤 幹男*; 杉原 崇*; 田中 公夫*; 小木曽 洋一*; 舟山 知夫; 和田 成一; 坂下 哲哉; 小林 泰彦
no journal, ,
低線量率放射線の緩慢照射による遺伝子発現の変化を調べる模擬実験系として、レポーター遺伝子を組み込んだマウス繊維芽細胞株(NIH3T3/pG13 Luc)へマイクロビーム照射を行った。照射方法及び細胞のp53転写活性の検出法を確立するため、接触阻害を起こさせた細胞に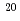 Neイオン(260MeV)によるブロード照射及びマイクロビーム照射を行った。p53転写活性の検出・測定は、溶解させた後の照射細胞試料のケミルミネセンス光強度と総蛋白質量を測定することで行った。ブロード照射では、非照射対照群の2倍のp53転写活性の上昇が見られたが、マイクロビーム照射の予備的検討では、照射点数が1から16点までの範囲で、有意差はないものの非照射対照群の30から40%の減少傾向を示した。照射点数密度に対するp53転写活性も、ほぼ反比例的に減少した。ペナンブラの範囲に含まれる細胞の体積は、最大でも試料細胞全体の約1/10,000に過ぎないことから、マイクロビーム照射のような少数のイオン照射では、バイスタンダー効果によって隣接細胞のp53転写活性が抑制される可能性も考えられる。
Neイオン(260MeV)によるブロード照射及びマイクロビーム照射を行った。p53転写活性の検出・測定は、溶解させた後の照射細胞試料のケミルミネセンス光強度と総蛋白質量を測定することで行った。ブロード照射では、非照射対照群の2倍のp53転写活性の上昇が見られたが、マイクロビーム照射の予備的検討では、照射点数が1から16点までの範囲で、有意差はないものの非照射対照群の30から40%の減少傾向を示した。照射点数密度に対するp53転写活性も、ほぼ反比例的に減少した。ペナンブラの範囲に含まれる細胞の体積は、最大でも試料細胞全体の約1/10,000に過ぎないことから、マイクロビーム照射のような少数のイオン照射では、バイスタンダー効果によって隣接細胞のp53転写活性が抑制される可能性も考えられる。
青谷 英明*; 舟山 知夫; 和田 成一*; 坂下 哲哉; 小林 泰彦; Hasan, K.*; Kaul, S.*; 高倉 かほる*
no journal, ,
重粒子線照射が培養細胞中に誘発するp53及び、p53と相互作用する蛋白質として近年新規同定されたCARFとの相互作用の解析を試みた。本研究では、照射試料としてヒト骨肉腫細胞U2OSを用い、原研高崎のイオン照射研究施設にて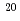 Ne(LET=430keV/
Ne(LET=430keV/ m)を照射した。参照実験として殺菌灯を用いて波長253nmのUV照射を行った。照射後一定時間培養後に細胞試料を回収し、p53, CARFの発現を抗体染色法及びウェスタンブロッティング法で検出し、p53とCARFの相互作用を免疫沈降法で分析した。p53の核内の蓄積はNeイオン照射とUV照射の双方で明確に見られ、照射後24時間で最大であった。CARFの発現はUV照射後に観察されたが、Neイオン照射では小さかった。またUV照射後にはp53とCARFの共局在が起こったが、Neイオン照射では起こらなかった。Neイオン照射,UV照射ともにp53の核内蓄積を誘導したが、p53とCARFの相互作用という点で違いを見ることができた。
m)を照射した。参照実験として殺菌灯を用いて波長253nmのUV照射を行った。照射後一定時間培養後に細胞試料を回収し、p53, CARFの発現を抗体染色法及びウェスタンブロッティング法で検出し、p53とCARFの相互作用を免疫沈降法で分析した。p53の核内の蓄積はNeイオン照射とUV照射の双方で明確に見られ、照射後24時間で最大であった。CARFの発現はUV照射後に観察されたが、Neイオン照射では小さかった。またUV照射後にはp53とCARFの共局在が起こったが、Neイオン照射では起こらなかった。Neイオン照射,UV照射ともにp53の核内蓄積を誘導したが、p53とCARFの相互作用という点で違いを見ることができた。
金杉 勇一*; 舟山 知夫; 和田 成一*; 坂下 哲哉; 小林 泰彦; 高倉 かほる*
no journal, ,
バイスタンダー効果の経路として、細胞間ギャップジャンクションによるものと、ラジカル等の培地溶解性因子によるものが考えられる。本研究では、照射試料として細胞培養ディッシュ底面に接着した細胞(GM05389)を用い、原研高崎のイオン照射研究施設にて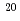 Ne(LET=430keV/
Ne(LET=430keV/ m)を照射した。また、参照実験として30kVpの軟X線による照射実験も行った。照射後、照射試料中の細胞(ドナー細胞)をフレッシュな培地で培養した後、その培地のみをほかの照射を受けていない細胞(レシピエント細胞)のディッシュに移し換えて、そのまま培養を経た後、カリクリンAを用いた未熟染色体凝縮法による染色体損傷の解析を行った。染色体損傷の測定結果から、照射を受けていないレシピエント細胞においても染色体損傷が誘起されることが観察された。また、DNA切断修復にかかわるDNA-PKを阻害する薬剤を、ドナー細胞,レシピエント細胞にそれぞれに添加したところ、この薬剤がバイスタンダー効果の増幅をもたらすことが認められた。
m)を照射した。また、参照実験として30kVpの軟X線による照射実験も行った。照射後、照射試料中の細胞(ドナー細胞)をフレッシュな培地で培養した後、その培地のみをほかの照射を受けていない細胞(レシピエント細胞)のディッシュに移し換えて、そのまま培養を経た後、カリクリンAを用いた未熟染色体凝縮法による染色体損傷の解析を行った。染色体損傷の測定結果から、照射を受けていないレシピエント細胞においても染色体損傷が誘起されることが観察された。また、DNA切断修復にかかわるDNA-PKを阻害する薬剤を、ドナー細胞,レシピエント細胞にそれぞれに添加したところ、この薬剤がバイスタンダー効果の増幅をもたらすことが認められた。
浜田 信行*; 和田 成一; 舟山 知夫; 坂下 哲哉; 柿崎 竹彦; 横田 裕一郎; 長谷 純宏; 小林 泰彦
no journal, ,
高LET放射線は、低LET放射線に比べ、生物学的効果が高く、物理学的特性に優れていることから、がんをはじめとした放射線治療に応用されている。しかし、がん病巣には正常細胞が混在し、また、照射野周囲に正常細胞が存在することから、正常組織への被曝は不可避である。そこで、本研究では、高密度接触阻害培養したヒト正常二倍体線維芽細胞において、エネルギーとLETが異なる6種の高LET重イオンの生物効果を解析することを目的とした。重イオンの照射は、原子力機構高崎研のTIARAにて行った。コロニー形成法の解析結果から、低LET放射線である 線(0.2keV/
線(0.2keV/ m)による10%生存線量を基準とした場合に、重イオンのRBEは、それぞれ1.4(
m)による10%生存線量を基準とした場合に、重イオンのRBEは、それぞれ1.4(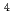 He, 16keV/
He, 16keV/ m), 3.0(
m), 3.0(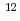 C, 76keV/
C, 76keV/ m), 3.9(
m), 3.9(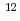 C, 108keV/
C, 108keV/ m), 3.4(
m), 3.4(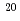 Ne, 321keV/
Ne, 321keV/ m), 2.7(
m), 2.7(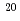 Ne, 437keV/
Ne, 437keV/ m), 0.8(
m), 0.8(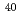 Ar, 1610keV/
Ar, 1610keV/ m)であった。今後は、照射生存子孫細胞における遅延的細胞増殖死、及び、照射細胞周囲におけるバイスタンダー効果を解析する。
m)であった。今後は、照射生存子孫細胞における遅延的細胞増殖死、及び、照射細胞周囲におけるバイスタンダー効果を解析する。